检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 澳门太阳集团官网www / 学术科研
2020年9月11日,太阳集团见好就收9728李龙研究组与李晴研究组合作在《Cell Research》杂志,发表了题为 “Structure of the mitochondrial TIM22 complex from yeast” 的研究论文。
线粒体是能量产生的动力工厂,是许多细胞过程必不可少的,如脂类和氨基酸代谢、细胞信号传导和细胞凋亡等。线粒体功能障碍与帕金森综合症、癌症和心血管疾病等多种人类疾病息息相关。目前已知,线粒体有1000多种蛋白质,其中大部分由细胞核DNA编码,并从细胞质中导入线粒体的双层膜结构中,而这些蛋白的导入机制非常不清楚。在1000多种线粒体蛋白中,很大一类跨膜蛋白需要通过TIM22复合物转运到内膜中。酿酒酵母(S. cerevisiae)中的TIM22复合体包含7个亚基:Tim22, Tim18, Tim54, Sdh3, Tim9, Tim10, and Tim12,其中Tim22被认为是核心亚基。虽然早在2003年就有关于TIM22复合物负染结构的报道,但是由于TIM22复合物组分众多、内源表达量低、纯化复杂等众多原因,导致一直无法获得其高分辨率结构,进而阻碍了人们对于TIM22复合物转运蛋白机制的理解。
在本研究中,作者采用酿酒酵母(S. cerevisiae)内源TIM22复合体作为研究对象,通过冷冻电镜技术首次获得了该复合物3.8Å分辨率的结构。在该结构中可以清晰的识别出7个亚基的位置和构象(图1a)。
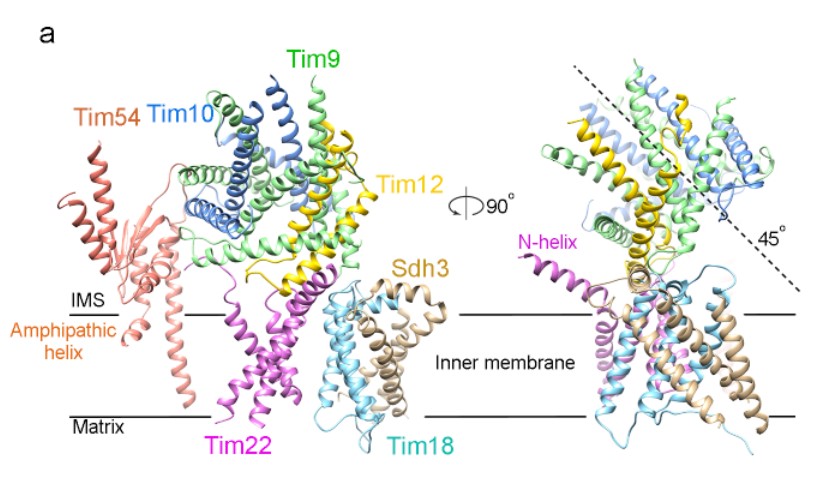
图1:酵母源TIM22复合物七个亚基的结构
从结构中可以看出TIM22复合物中膜外区的小Tim亚基形成了六聚体环,并以约45°的倾角位于膜上(图1a),可用于接收转运底物并将底物传送至Tim22亚基。在膜内区,Tim18、Sdh3和Tim22彼此靠近。三个膜亚基一起为小的Tim亚基六聚体环提供了对接平台。Tim22有4个跨膜区形成一个曲面,凹面面向脂类,凸面面向Tim18。
与先前的研究表明TIM22复合物可能作为双孔转位酶的结论有很大不同,此TIM22复合物的结构未显示出明显的底物转运通道[1]。作者认为,单个Tim22亚基可能足以作为一个跨膜肽段插入酶。Tim22的第二个跨膜区中带电残基的分布可能会减少局部脂质膜的厚度,较薄的膜中的带电环境可以极大地降低跨膜肽段插入的能量势垒,从而帮助底物入膜。还有一种可能是该结构揭示的TIM22复合物是处于无底物状态或者底物转运中间态的构象。在膜电位的驱动下,TIM22复合物,特别是Tim22亚基,可能经历构象变化而寡聚化并形成孔道。
总之,TIM22复合物的结构揭示了其7个亚基的精妙组成。Tim18-Sdh3和Tim22为固定Tim9-Tim10-Tim12提供了一个对接平台。Tim9-Tim10-Tim12位于组装的中心,可能接收底物并将其传递给Tim22。Tim54有助于将Tim9-Tim10-Tim12保持在倾斜状态。Tim22可以在通道内或膜内创造亲水环境,以促进膜蛋白底物插入膜内。本项研究为今后线粒体内膜蛋白转运机理的研究提供了坚实的基础。
太阳集团见好就收9728太阳集团见好就收9728李龙研究员为该论文通讯作者,18级生命科学联合中心博士生张妤彤和资深实验员欧晓敏为共同第一作者。李晴组的博士生王雪征负责了酵母遗传表型实验。李宁宁,王国鹏和向烨在冷冻电镜数据分析上提供了帮助,高宁教授为文章提出了宝贵意见。该研究工作得到太阳集团见好就收9728冷冻电镜平台、高性能计算中心、生科院仪器中心、膜生物学国家重点实验室以及北大清华-生命科学联合中心的支持。
原文链接:https://doi.org/10.1038/s41422-020-00399-0
[1] Rehling, P. et al. Protein Insertion into the Mitochondrial Inner Membrane by a Twin-Pore Translocase. Science 299, 1747, doi:10.1126/science.1080945 (2003).