检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 澳门太阳集团官网www / 学术科研
2021 年 2 月 23 日,太阳集团见好就收9728蛋白质与植物基因研究国家重点实验室、我院孔道春实验室在Cell在线发表了题为RNA polymerase III is required for the repair of DNA double-strand breaks by homologous recombination 的研究论文。该研究发现RNA-DNA 杂交链中间体和RNA 聚合酶III这两个组分是DNA同源重组过程所必需,解决了真核细胞DNA同源重组领域里一个长期悬而未决的核心问题,把对DNA同源重组事件分子机制的理解提高到了一个新的层次。

图1. 减数分裂期姐妹染色体重组
https://en.wikipedia.org/wiki/Homologous_recombinati on#/media/File:HR_in_meiosis.svg
DNA同源重组由三大主要步骤组成(图2):1)链末端切除(end resection):由MRN-CtIP、DNA2、EXO1等核酸酶对DNA双链断裂(DNA double-strand break, DSB)处进行5’-链降解,切除大约几千个核苷酸,导致3’-单链DNA形成;2)3’-单链DNA入侵同源DNA模板链(strand invasion):通过多个蛋白帮助,Rad51包裹 3’-单链DNA形成核酸-蛋白复合体,该复合体侵入同源DNA链,3’-单链DNA作为引物进行DNA合成;3)解开Holliday Junction(HJ)结构(resolution of Holliday Junction):3’-单链 DNA 侵入同源DNA模板链后,随后进行的DNA合成及链交换反应,导致HJ结构形成,相关核酸酶解开HJ结构,最终完成DNA同源重组过程。
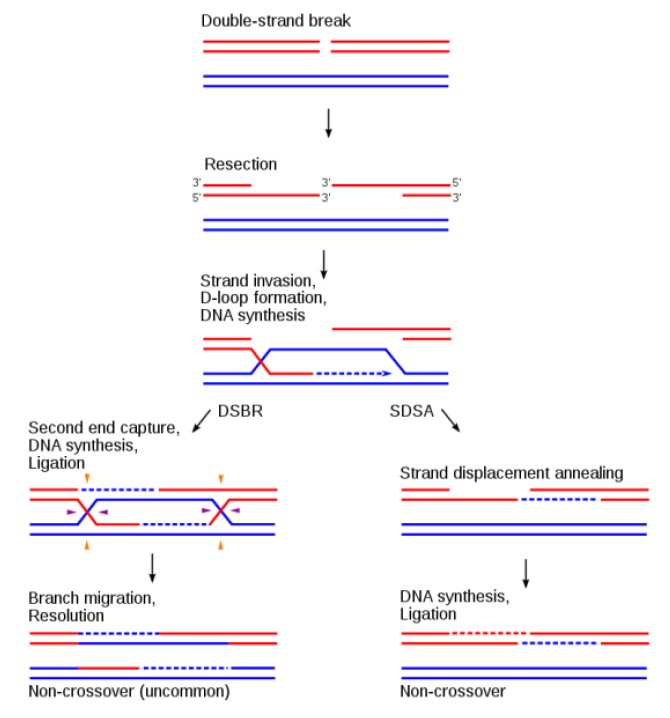
图2. 同源重组的一般过程
Sung P, Klein H (2006). "Mechanism of homologous recombination: mediators and helicases take on regulatory functions". Nature Reviews Molecular Cell Biology 7: 739-750.
DNA同源重组领域的一个关键问题一直有待阐明:即细胞是如何进行末端切除 5’-链的几千个核苷酸,但又保证 3’-链的绝对完整。过去二三十年,一个普遍被认可或接受的观点是:3’ -单链是通过RPA(replication protein A,a single- strand DNA binding complex)的结合来保护的。但是,此观点缺乏确切的实验证据。再进一步考虑,用蛋白结合的方式来保护几千个核苷酸长度的单链DNA,避免被核酸酶攻击,从理论上讲,这个可能性非常小,理由有三个:1)细胞如何能做到蛋白结合能早于核酸酶攻击;2)细胞如何能做到几千个核苷酸长度的每一个核苷酸都被蛋白覆盖而不留任何被核酸酶攻击的空隙;3)蛋白结合到DNA不可能是恒定的,有结合-脱离-再结合事件发生,蛋白一旦脱离DNA, 核酸酶就得到了攻击DNA的机会。具体到此生物事件,研究者不认为细胞能做到第一和第二点,第三点是客观现实存在。因此,研究者认为细胞必定用其它机制来保护DNA断裂处的3’-单链DNA。
在该研究中,孔道春实验室发现3’-单链DNA是通过形成暂时的RNA-DNA杂交链来得到保护,催化此RNA链合成的是RNA聚合酶 III。如果阻止此处RNA合成,则DNA同源重组终止,并造成基因缺失。因此,RNA 聚合酶III是同源重组的一个必需因子,RNA-DNA杂交链是DNA同源重组事件的一个必需中间体。图3是DNA同源重组的最新模型。RNA-DNA杂交链中间体的发现推进了真核细胞DNA同源重组领域里一系列长期悬而未决问题的解决,并加深了对DNA同源重组事件分子机制的理解;同时,该成果将促进包括疾病的基因治疗、动植物新种质的开发、抗癌药物的研发等相关领域的技术开发。
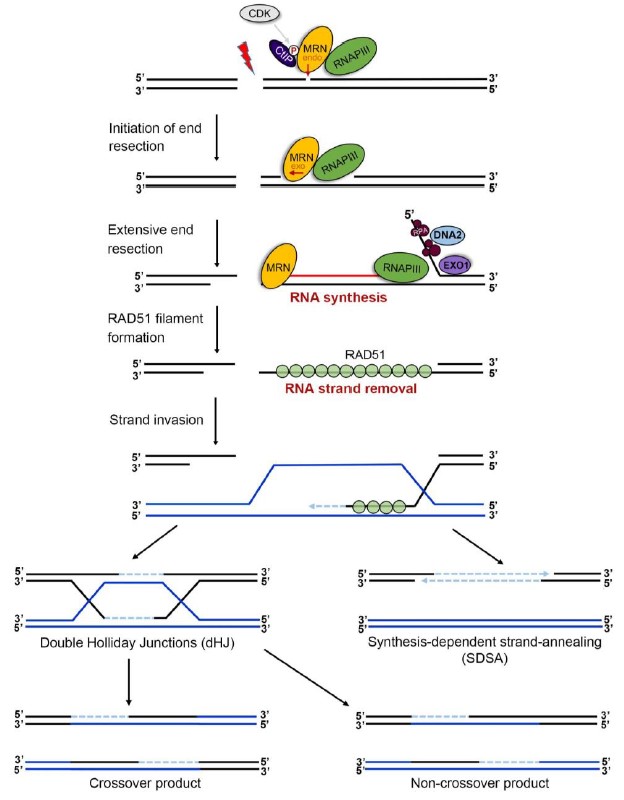
图3. 新的 DNA 同源重组模型
孔道春教授为该论文的通讯作者;刘思杰博士、华余博士、王静娜副教授、以及孔道春实验室技术员李凌彦为该论文的共同第一作者。袁俊杰、张波、王子阳,以及国家重点实验室纪建国教授也为该论文作出了重要贡献,孔道春实验室其他成员对本论文也提供了帮助。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(21)00091-X