检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 澳门太阳集团官网www / 学术科研
口腔鳞状细胞癌(OSCC)是头颈部鳞状细胞癌的主要类型,恶性程度高,5年生存率为50%,是一种多阶段渐进恶变的恶性肿瘤,可从正常黏膜-癌前病变-癌演变而来,其中口腔白斑(OLK)是最常见的口腔癌前病变,口腔白斑恶变率可达11.7-23.1% [1,2]。因此,若能在癌前病变阶段施加干预措施,则可有效预防口腔黏膜癌变,提高患者生存率。近年来,以抗PD-1抗体为核心的免疫治疗在全身多种肿瘤治疗中取得重要进展,但在口腔鳞癌中应答率不到20%,提示存在其它免疫逃逸途径[3]。因此,需要对口腔癌变进程中细胞类型和分布的动态变化进行全面的表征,寻找该进程中介导免疫逃逸的关键分子,为口腔鳞癌的治疗提供新的靶点。
2022年8月16日,来自中山大学附属口腔医院的王智教授团队以及太阳集团见好就收9728生物医学前沿创新中心(BIOPIC)、我院的白凡教授团队联合在The Journal of Clinical Investigation杂志发表题为TDO2+ myofibroblasts mediate immune suppression in malignant transformation of squamous cell carcinoma的研究论文。该研究采用单细胞多组学技术和体内体外实验,发现TDO2+肌成纤维细胞是介导T细胞免疫抑制的关键细胞亚群。
该研究对13例口腔鳞癌组织、3例白斑组织和8例癌旁正常组织进行单细胞测序,并对T细胞进行了V(D)J测序,共获得131702个高质量细胞,最终定义了10个细胞亚群(图1)。
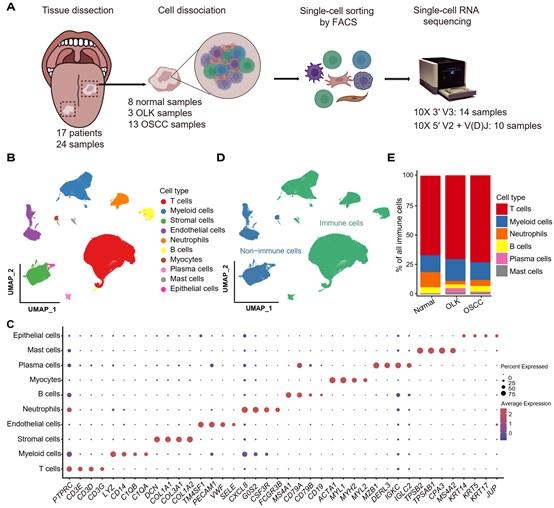
图1: 单细胞测序流程和主要细胞类型
研究发现,随着口腔癌变的进展,CD4+ T细胞中静止及活化的调节性T细胞(Tregs)、耗竭CD4+ T细胞占比逐渐升高;具有高增殖能力的过渡态CD4+ T细胞主要分化为活化的Tregs以及耗竭CD4+ T细胞(图2A-D)。此外,研究者发现CD8+ T细胞存在终末耗竭、过渡耗竭和前体耗竭CD8+ T细胞亚群,并且在癌旁-癌前病变-癌组织中均呈逐渐升高的趋势,前体耗竭及过渡耗竭CD8+ T细胞均朝向终末耗竭方向分化(图2E-H)。以上结果显示在口腔癌变过程中CD4+及CD8+ T细胞均存在表型转换,其中CD4+ T细胞主要转换为具有免疫抑制功能的Tregs,而CD8+ T细胞则转换为耗竭表型。
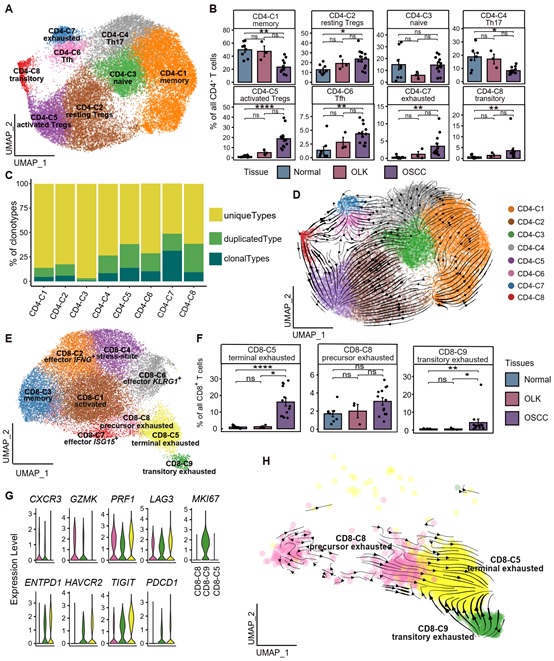
图2: 口腔癌变进程中CD4+/CD8+ T细胞的亚群分布和分化轨迹
为探究肿瘤微环境中基质细胞是否可介导T细胞免疫抑制,研究者对基质细胞进行聚类分群,发现基质细胞中存在2群肌成纤维细胞亚群,两个亚群均呈现在癌旁正常组织中缺失,在癌前病变和癌组织中逐渐增加的特征(图3A-B)。进一步分析发现,其中一个亚群(MF-C1-TDO2,高表达TDO2和CXCL9)同时具有T细胞趋化和色氨酸代谢功能,而另一个亚群(MF-C2-ELN,高表达ELN)则具有基质重塑功能(图3C-G)。通过免疫荧光证实TDO2仅表达于癌组织的a-SMA+肌成纤维细胞中(图3F),并且通过多色免疫组化(mIHC)染色证明其主要位于癌巢组织外围(图4A-D)。组织内mIHC染色及体外高内涵成像结果显示该群TDO2+肌成纤维细胞具有较强的T细胞趋化功能(图4E-H)。
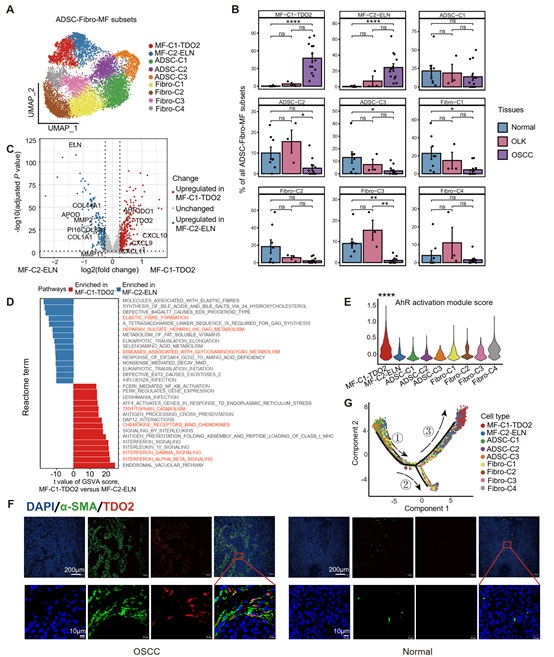
图3: 口腔癌变进程中肌成纤维细胞的亚群分布、功能差异和分化轨迹
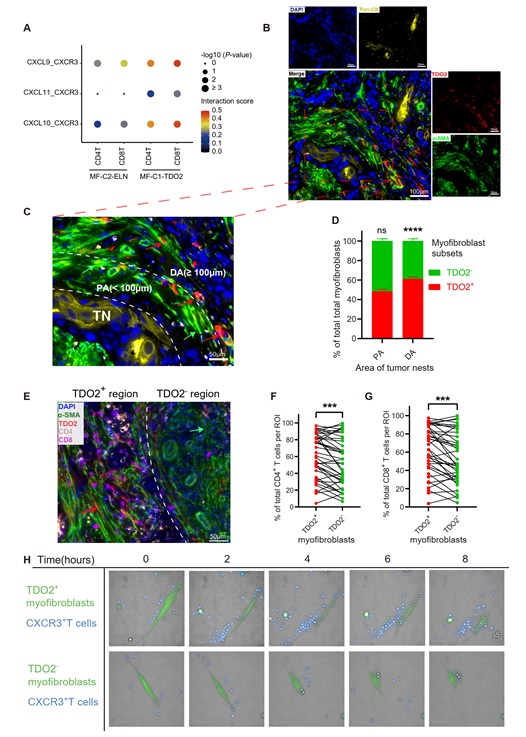
图4: TDO2+肌成纤维细胞在口腔癌中的空间分布和体外高内涵成像结果
上述结果显示TDO2+肌成纤维细胞位于癌巢外围,并具有强烈的T细胞趋化功能,那么该群细胞是否介导T细胞免疫抑制呢?通过mIHC染色,研究者发现TDO2+肌成纤维细胞周围富集更多的Tregs (Foxp3+ CD4+)和耗竭 CD8+ T 细胞(TIM-3+ PD-1+ CD8+)。为进一步探究TDO2+肌成纤维细胞对T细胞的影响,研究者利用siRNA对口腔癌组织中分离的肌成纤维细胞进行TDO2基因敲低后,与CD4+/CD8+ T细胞共培养,结果显示共培养体系中的Tregs和耗竭CD8+ T细胞占比均降低,同时CD8+ T细胞的杀伤功能增强。采用TDO2抑制剂LM10处理肌成纤维细胞可观察到相似结果。此外,免疫组化染色结果显示肿瘤间质中高丰度TDO2+肌成纤维细胞可提示口腔鳞癌患者预后较差(图5)。
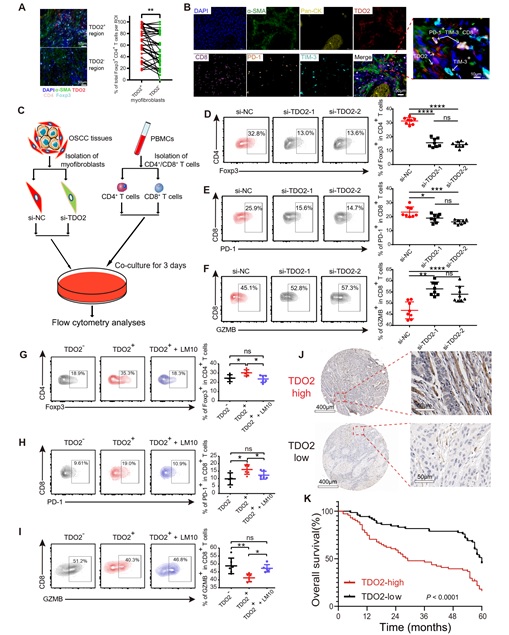
图5: TDO2+肌成纤维细胞对CD4+/CD8+ T细胞的抑制作用
研究结果证明,虽然TDO2+肌成纤维细胞具有较强的T细胞趋化功能,但是趋化而来的CD4+/CD8+ T细胞出现明显的免疫抑制状态,提示该群肌成纤维细胞可能在癌巢外围构筑“陷阱”,通过TDO2催化的色氨酸代谢途径,诱导T细胞免疫抑制,促进肿瘤免疫逃逸。该结果可部分解释为何口腔黏膜恶变进程中虽然病损内有大量T细胞浸润,但仍出现PD-1治疗抵抗的原因。
最后,研究者采用4NQO诱导小鼠口腔内自发成瘤,并采用TDO2抑制剂LM10进行体内治疗,结果显示TDO2抑制剂可有效阻止小鼠口腔黏膜白斑恶变(图6)。此外,采用小鼠口腔癌细胞进行小鼠皮下成瘤,证实TDO2抑制剂联合抗PD-1抗体在阻止口腔鳞癌进展中有更好的效果(图7A-B),而在裸鼠身上TDO2抑制剂没有发挥作用(图7C-D),提示TDO2抑制剂介导的抗肿瘤反应呈T细胞依赖性。
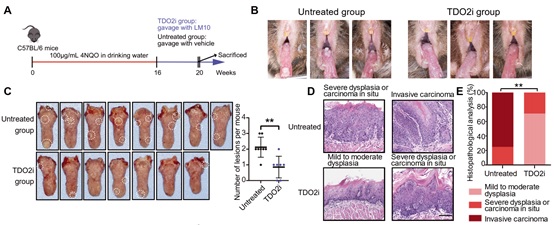
图6: TDO2抑制剂可有效阻止口腔黏膜癌变
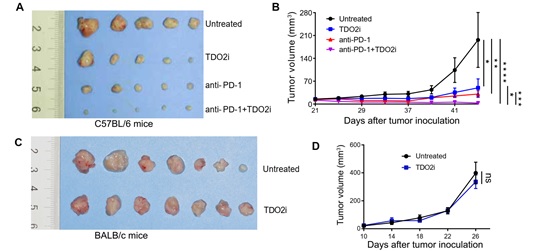
图7: TDO2抑制剂联合抗PD-1抗体在阻止口腔鳞癌进展中有更好的效果
该研究系统描绘了口腔黏膜癌变进程中T细胞、髓系细胞和中性粒细胞等免疫细胞以及基质细胞的动态变化图谱,并发现在口腔癌巢外周TDO2+肌成纤维细胞具有较强的T细胞趋化和抑制功能,通过实验证明抑制该群肌成纤维细胞可有效促进抗肿瘤免疫反应。本研究为口腔鳞癌的免疫逃逸提出了新的机制,为阻断口腔癌的发生发展提供了新的靶点。
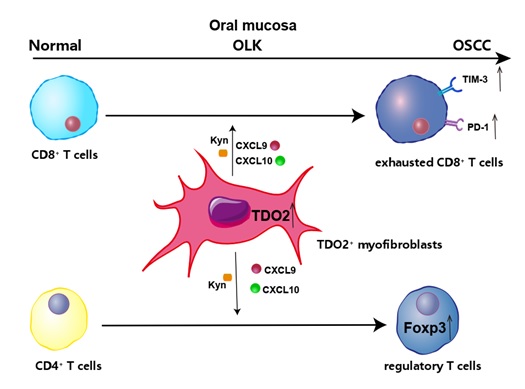
图8: TDO2+肌成纤维细胞是介导口腔癌中T细胞免疫抑制的关键亚群
中山大学附属口腔医院的王智教授以及太阳集团见好就收9728生物医学前沿创新中心(BIOPIC)、我院白凡教授是本文的共同通讯作者。太阳集团见好就收9728BIOPIC、前沿交叉学科研究院的博士研究生胡思梦、中山大学附属口腔医院的卢涣滋博士、谢文强博士和王迪侃博士是本文的共同第一作者。
原文链接:https://www.jci.org/articles/view/157649
参考文献
1. Chi AC, et al. Oral cavity and oropharyngeal squamous cell carcinoma--an update. CA Cancer J Clin. 65(5), 401-421(2015).
2. Yardimci G, et al. Precancerous lesions of oral mucosa. World J Clin Cases. 2(12), 866-872(2014).
3. Schoenfeld JD, et al. Neoadjuvant nivolumab or nivolumab plus ipilimumab in untreated oral cavity squamous cell carcinoma: a phase 2 open-label randomized clinical trial. JAMA Oncol. 6(10), 1563-1570(2020).