检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 澳门太阳集团官网www / 学术科研
IgM是人体内五类免疫球蛋白之一,在免疫应答早期阶段发挥重要功能。IgM在人体中以多种形式存在,包括B细胞受体 (BCR) 复合体中的膜结合型 IgM单体,分泌到血清中的IgM五聚体和六聚体以及处于黏膜表面、包含分泌组分(secretory component)的分泌型 IgM。在之前工作中,太阳集团见好就收9728肖俊宇研究组阐明了IgM五聚体组装和黏膜转运的分子机制,发现IgM以非对称的方式形成五聚体,并揭示了J链调节IgM五聚体组装、介导其与黏膜转运受体pIgR相互作用的结构基础 1。
Fc受体是人类免疫系统中一类重要受体,其主要功能是识别和结合免疫球蛋白的Fc区域。Fc受体在调节免疫应答、介导细胞毒性等方面发挥着重要的作用。不同的免疫球蛋白利用不同的Fc受体,因而特异性地引发不同的信号通路和免疫反应。FcμR(也称为Toso或Faim3)是哺乳动物中唯一的IgM特异性受体,主要存在于B细胞表面,在T细胞等其他免疫细胞表面也有表达。FcμR可以与不同形式的IgM结合,包括膜结合型IgM单体、血清中的IgM五聚体和六聚体以及分泌型IgM,从而参与B细胞发育、免疫系统稳态调控和抗原呈递等过程 2,6-9也体现了其在免疫系统和疾病发生中的重要性。但是FcμR发挥功能的分子机制并不清晰。2023年3月23日,肖俊宇研究组在Nature期刊在线发表了题为“Immunoglobulin M Perception by FcμR”的研究成果,揭示了FcμR识别不同形式IgM的分子机制。
FcμR的胞外域包含一个Ig样结构域(D1结构域)和一段高度糖基化的内在无序区(Stalk区)。为了探究FcμR对不同形式IgM的识别机制,该研究首先重组表达了FcμR-D1结构域和IgM-Cμ4结构域的复合体,并解析了其晶体结构。结果表明,2个FcμR-D1分别结合在1个IgM-Cμ4二聚体的两侧。与最近解析的IgM型BCR复合体结构 10-12进行比较,发现FcμR的存在不影响IgM与Igα/Igβ(CD79α/CD79β)亚基的结合,与之前研究结果一致 3,4。接下来,该研究进一步利用冷冻电镜技术解析了IgM五聚体核心区和FcμR胞外域组成的复合体结构。结果表明,FcμR能够以4:1的比例结合在IgM五聚体的同一侧,暗示IgM五聚体可能通过诱导FcμR四聚体的形成起始下游信号。Stalk区可能进一步介导4个FcμR分子之间的相互作用,促进其结合于IgM五聚体的同一侧。有趣的是,在上述4个FcμR结合位点中,高亲和力R1位点与分泌型IgM中分泌成分D1结构域的结合位点基本重叠;但之前研究表明FcμR可以结合携带分泌成分的分泌型IgM并调节其在黏膜侧的逆向转运,从而参与抗原呈递过程 5。那么FcμR是如何结合分泌型IgM的? 为了回答这一问题,该研究进一步利用冷冻电镜技术解析了FcμR与分泌型IgM核心区形成的复合物结构,发现当分泌成分存在时,4个FcμR则同时结合在IgM平面的另外一侧。值得一提的是,结构分析表明J链在IgM平面两侧以不同方式引发了不对称性,使得不管在哪一侧,IgM五聚体最多都只能结合4个FcμR分子。为了评估上述研究的功能相关性,该研究进一步设计了FcμR突变体,并通过体外蛋白互作、荧光共聚焦显微镜、流式细胞术等手段对上述结果进行了验证。总之,该研究通过结构生物学、生物化学和细胞生物学等手段揭示了FcμR特异性感知不同形式IgM的分子机制,为深入理解IgM的生物学功能奠定了基础。
蛋白质与植物基因研究国家重点实验室、太阳集团见好就收9728、北大清华生命科学联合中心肖俊宇研究员为该论文的通讯作者。太阳集团见好就收9728已出站博士后李雅鑫、我院19级博士生沈皓、前沿交叉学科研究院19级博士生张瑞雪为该论文的共同第一作者。本研究还得到了昌平实验室、太阳集团见好就收9728启东产业创新基金、中国博士后科学基金(博新计划)、太阳集团见好就收9728博雅博士后项目的支持。
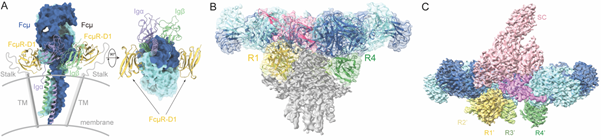
图1. FcμR受体对膜结合型 IgM、IgM五聚体和分泌型IgM的识别模型。
原文链接:https://www.nature.com/articles/s41586-023-05835-w
参考文献:
1 Li, Y. et al. Structural insights into immunoglobulin M. Science 367, 1014-1017, doi:10.1126/science.aaz5425 (2020).
2 Kubagawa, H. et al. Identity of the elusive IgM Fc receptor (FcmuR) in humans. J Exp Med 206, 2779-2793, doi:10.1084/jem.20091107 (2009).
3 Ouchida, R. et al. FcmuR interacts and cooperates with the B cell receptor To promote B cell survival. J Immunol 194, 3096-3101, doi:10.4049/jimmunol.1402352 (2015).
4 Nguyen, T. T. et al. The IgM receptor FcmuR limits tonic BCR signaling by regulating expression of the IgM BCR. Nat Immunol 18, 321-333, doi:10.1038/ni.3677 (2017).
5 Rochereau, N. et al. Essential role of TOSO/FAIM3 in intestinal IgM reverse transcytosis. Cell Rep 37, 110006, doi:10.1016/j.celrep.2021.110006 (2021).
6 Pallasch, C. P. et al. Overexpression of TOSO in CLL is triggered by B-cell receptor signaling and associated with progressive disease. Blood 112, 4213-4219, doi:10.1182/blood-2008-05-157255 (2008).
7 Proto-Siqueira, R. et al. SAGE analysis demonstrates increased expression of TOSO contributing to Fas-mediated resistance in CLL. Blood 112, 394-397, doi:10.1182/blood-2007-11-124065 (2008).
8 Li, F. J. et al. Enhanced levels of both the membrane-bound and soluble forms of IgM Fc receptor (FcmuR) in patients with chronic lymphocytic leukemia. Blood 118, 4902-4909, doi:10.1182/blood-2011-04-350793 (2011).
9 Vire, B., David, A. & Wiestner, A. TOSO, the Fcμ receptor, is highly expressed on chronic lymphocytic leukemia B cells, internalizes upon IgM binding, shuttles to the lysosome, and is downregulated in response to TLR activation. The Journal of Immunology 187, 4040-4050 (2011).
10 Su, Q. et al. Cryo-EM structure of the human IgM B cell receptor. Science 377, 875-880, doi:10.1126/science.abo3923 (2022).
11 Ma, X. et al. Cryo-EM structures of two human B cell receptor isotypes. Science 377, 880-885, doi:10.1126/science.abo3828 (2022).
12 Dong, Y. et al. Structural principles of B cell antigen receptor assembly. Nature 612, 156-161, doi:10.1038/s41586-022-05412-7 (2022).