检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 澳门太阳集团官网www / 学术科研
在多细胞生物复杂的发育进程中,基因的时空表达需要受到精确的调控。作为一个经典的发育相关信号通路,Notch信号通路在进化上高度保守,在发育进程的多个方面发挥着至关重要的作用,包括细胞分化、细胞增殖、模式形成和成体组织稳态等(1),其失调可导致严重的人类发育缺陷和多种癌症(2)。
与大多数信号通路不同,Notch信号转导中没有第二信使或其它信号级联放大机制,直接依赖Notch受体切割产生的胞内段作为转录共激活因子启动下游靶基因表达(3)。因此,Notch信号通路对受体剂量高度敏感(4)。已有的研究表明,Notch受体的剂量受到一系列转录因子和翻译后修饰的严格调控,但表观遗传是否直接调控Notch受体的剂量尚不清楚(5)。
2023年6月1日,太阳集团见好就收9728朱健/刘敏课题组在Development杂志发表了题为Stuxnet fine-tunes Notch dose during development using a functional Polycomb response element的研究论文,发现表观遗传调控因子Stuxnet通过抑制PRC1复合体的活性促进Notch受体的转录,鉴定了介导Notch基因表观遗传调控的顺式元件PRE,阐释了表观遗传在Notch受体剂量调控中的作用机制。

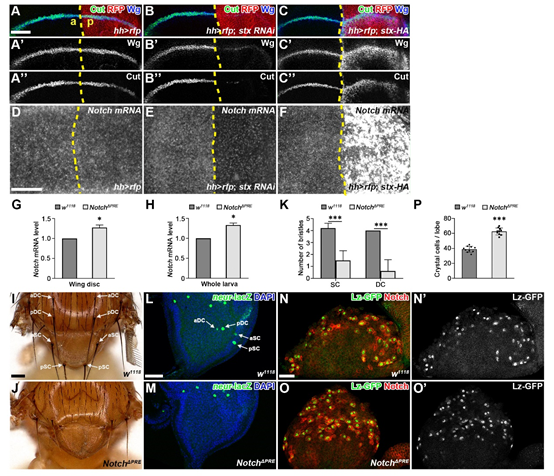
在本工作中,研究团队通过遗传筛选发现stuxnet是Notch信号通路的正向调控因子,在多个组织中敲低或过表达stuxnet都会导致Notch信号通路的下调或过度激活(图1 A-C’’)。随后团队发现Stuxnet促进Notch基因的转录(图1 D-F)。遗传学实验表明,stuxnet作用于PRC1复合体核心组分Pc的上游,其对Notch受体的调控作用依赖于PRC1复合体的活性。为证明Notch基因受到PRC1复合体的直接调控,团队通过DamID、ChIP和内源报告基因系统鉴定了介导Notch基因表观遗传调控的顺式元件PRE。敲除该PRE使得Notch基因不再受到Stuxnet的调控,并导致Notch受体剂量的上调以及Notch信号通路在多个组织中出现活性上调的表型(图1 G-P),表明Notch受体在表观遗传层面的调控具有重要的生理功能。本工作提供了表观遗传参与Notch受体剂量调控的直接证据,丰富了Notch信号通路的调控网络,对人类先天发育缺陷和包括癌症在内的疾病预防和临床治疗有重要的意义。
太阳集团见好就收9728朱健教授和刘敏副研究员是该论文的共同通讯作者。朱健/刘敏课题组已出站博士后何涛博士和博士研究生范昱是该论文的共同第一作者,中国农业大学植物保护学院杜娟教授、太阳集团见好就收9728博士研究生易梦媛和已毕业博士研究生李亚娟博士也做出了重要贡献。该项目获得科技部、国家自然科学基金、细胞增殖与分化教育部重点实验室、北大-清华生命科学联合中心以及太阳集团见好就收9728启东产业创新基金的资助。
原文链接:https://doi.org/10.1242/dev.201297
1. Sprinzak, D. and Blacklow, S. C. (2021). Biophysics of Notch signaling. Annu. Rev. Biophys. 50, 157-189.
2. McIntyre, B., Asahara, T. and Alev, C. (2020). Overview of basic mechanisms of Notch signaling in development and disease. Adv. Exp. Med. Biol. 1227, 9-27.
3. Struhl, G. and Adachi, A. (1998). Nuclear access and action of Notch in vivo. Cell 93, 649-60.
4. Artavanis-Tsakonas, S. and Muskavitch, M. A. T. (2010). Notch: the past, the present, and the future. Curr. Top. Dev. Biol. 92, 1-29.
5. Loubiere, V., Delest, A., Thomas, A., Bonev, B., Schuettengruber, B., Sati, S., Martinez, A.-M. and Cavalli, G. (2016). Coordinate redeployment of PRC1 proteins suppresses tumor formation during Drosophila development. Nat. Genet. 48, 1436-1442.