检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 澳门太阳集团官网www / 学术科研
2018年3月14日,国际知名学术期刊Nucleic Acids Research以长文形式在线发表了太阳集团见好就收9728陆剑课题组题为“Drosophila tsRNAs preferentially suppress general translation machinery via antisense pairing and participate in cellular starvation response”(DOI:10.1093/nar/gky189)的研究论文。该论文首次报道了果蝇中来源于tRNA的小RNA(tRNA-derived small RNAs, tsRNA)对靶基因的调控机制和在胁迫应答中的重要作用。
来源于tRNA的tsRNA是近年新发现的一类小RNA,研究发现tsRNA并非tRNA的随机降解产物,其与环境胁迫应答、细胞增殖和癌变、表观遗传等过程有关。先前研究表明tsRNA可以调控细胞的整体翻译水平,但是对其作用机制并没有统一的认识。
陆剑研究组首先通过对公共数据库中果蝇小RNA数据的分析,发现果蝇中大多数tsRNA是高度保守、普遍存在、并且有较高的丰度,揭示这些tsRNA可能有重要的生物学作用。结合tsRNA细胞转染、mRNA-seq、核糖体图谱(ribosome profiling)和双荧光素酶报告实验,他们发现tsRNA转染后能显著降低细胞的整体翻译水平,并且tsRNA通过进化上保守的互补序列来识别并抑制靶基因mRNA的翻译。他们靶基因预测结果显示tsRNA倾向于结合并抑制细胞翻译系统主要蛋白的mRNA分子,从而解释了tsRNA如何通过序列互补的模式来抑制细胞整体翻译水平。此外,对血清饥饿状态下的果蝇S2细胞的实验结果表明tsRNA参与了细胞的饥饿应答过程,并且这个过程是独立于mTOR通路,但是依赖于果蝇的AGO2蛋白。
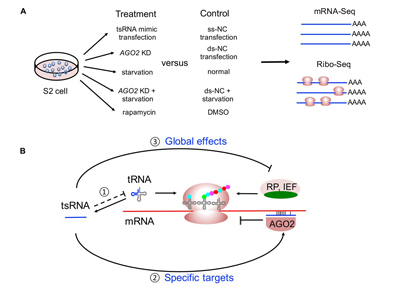
(A) 果蝇S2细胞的实验处理和测序流程;(B) 果蝇细胞“tsRNA连环计”的胁迫应答模型。
基于上述结果,该研究提出了果蝇细胞中“tsRNA连环计”的胁迫应答模型。在胁迫条件下,生物体的细胞翻译水平通常会下调。在“tsRNA连环计”模型中,首先tsRNA的生成会减少细胞中tRNA的丰度从而降低细胞整体翻译水平;其次tsRNA通过序列互补特异性抑制细胞翻译系统关键组分蛋白的mRNA自身翻译,从而降低细胞的整体翻译水平。基于tsRNA的连锁反应使得细胞能够迅速高效的产生胁迫应答。该研究首次揭示了果蝇中tsRNA介导的调控过程对细胞的能量平衡和代谢适应性的关键作用,对深入理解tsRNA的机制和功能提供了新的思路。
陆剑研究员为该论文的通讯作者。生科院博士后罗诗琦(现中国农业大学岗位科学家)、何峰(现浙江大学医学院讲师)、罗俊杰(现中国农业大学岗位科学家)、博士生窦圣乾、生命科学联合中心博士生王奕蓉是论文的共同第一作者,生命科学联合中心博士生郭安南为论文的共同作者。生科院研究生张宏同学亦对本研究提供了重要帮助。内华达大学的陈琦博士提供了建设性的意见。本研究得到了科技部、国家自然科学基金、中国博士后基金和北大-清华生命科学联合中心的支持。
原文链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gky189/4934130