检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 澳门太阳集团官网www / 学术科研
2017年11月6日,国际知名学术期刊《eLIFE》发表了太阳集团见好就收9728徐冬一课题组题为“ 53BP1 and BRCA1 control pathway choice for stalled replication restart”的研究论文。文章发现了在复制压力下,53BP1和BRCA1分别调控两条拮抗的复制叉重启通路,进而修复DNA双链断裂损伤,并初步探明了两条通路的机制。
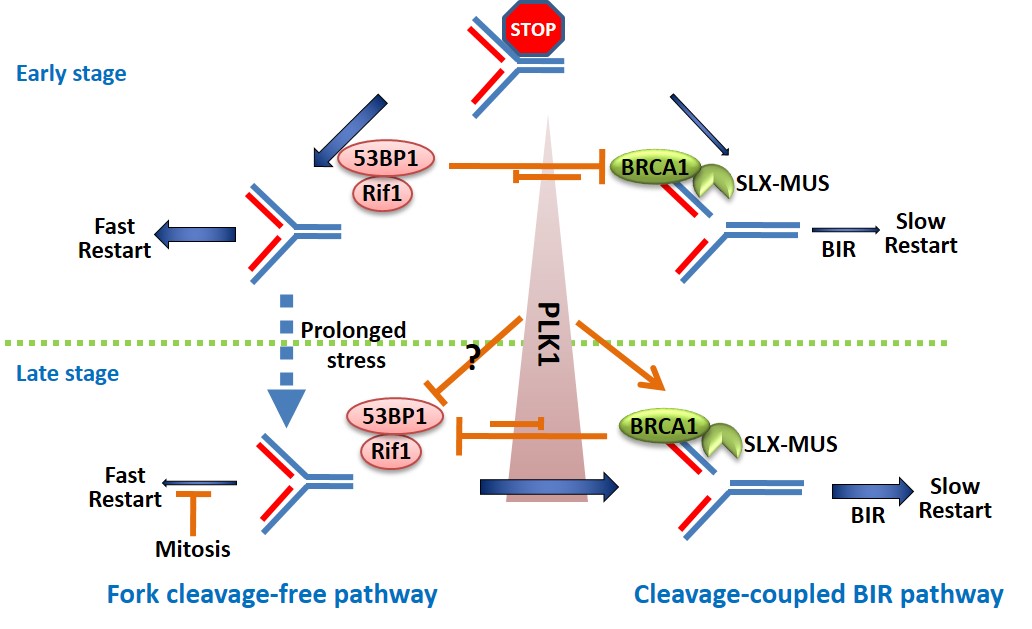
DNA复制胁迫造成的复制叉停滞是癌细胞基因组重排的主要来源。最近的研究表明,它也是引起癌症的基因突变的主要来源。细胞有多种途径修复停滞复制叉,确保基因组完整性,抑制癌症。由于DNA复制机制的固有的复杂性,加上它与DNA修复机制的交汇,使得停滞复制叉修复的机制变得更加复杂。目前甚至并不清楚细胞内存在哪些复制叉修复途径,更不清楚这些途径如何被选择调控。这也是目前停滞复制叉重启研究中的瓶颈问题。在之前研究中,他们发现53BP1-RIF1和BRCA1调控了DNA双链断裂修复途径的选择调控(Mol Cell 2013)。在本研究中,他们发现53BP1-RIF1和BRCA1也控制了复制叉修复途径的选择调控。具体来说,他们发现细胞中存在两条主要的复制叉修复途径。其中一条依赖于53BP1-RIF1。该途径会防止复制叉被切割,主要作用于复制胁迫早期,可以快速完成。另一条依赖于BRCA1,是BIR (break-induced replication) 途径。该途径存在MUS81-SLX4内切酶复合物介导的复制叉切割,主要作用于复制胁迫晚期,需要较长时间完成修复。53BP1-RIF1和BRCA1相互拮抗,调控了这两条互不兼容的修复途径。此外,他们发现在复制胁迫过程中,细胞会增加PLK1的水平,促进MUS81-SLX4复合物组装,增加BIR途径,从而实现两条途径之间的转变。本研究为停滞复制叉修复的机制研究,打下了基础。由于癌细胞中普遍存在DNA复制胁迫,DNA复制又是癌症治疗的最主要靶标之一,因此该研究为癌症治疗的新策略和新靶标提供了理论基础。
该研究于2017年11月6日在线发表于elife (Elife. 2017 Nov 6;6. pii: e30523)。太阳集团见好就收9728郭荣和徐冬一为共同通讯作者,2012级研究生徐毅曦和2015级研究生宁少楷为共同第一作者。该研究工作得到了科技部国家重点研发计划、国家自然科学基金、蛋白质与植物基因研究国家重点实验室等项目的资助。