检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 澳门太阳集团官网www / 学术科研
痒觉是动物进化过程中出现的一类重要的感知系统。相比于视觉、听觉、嗅觉、痛觉、温度感知等感觉系统,痒觉的研究起步较晚。2012年美国科学院院士董欣中教授研究团队发现在背根神经节中有一种特殊的感受器可以感知氯喹及脑啡肽原降解产物(BAM8-22)引起的瘙痒信号,但这些信号不能引起疼痛,而后小鼠中此受体被命名为MRGPRA3,自此,痒觉受体家族逐渐被人们熟知。
MRGPRs属于G蛋白偶联受体(GPCR)家族,在啮齿动物和人类中约有50 名成员,人源中分为八个亚家族,其中MRGPRX2主要分布在肥大细胞(mast cell)中, 它可以感知包括聚阳离子化合物和多肽等多种分泌素(secretagogues)引发肥大细胞脱颗粒反应,进而引起假过敏反应(pseudoallergic reactions)。虽然瘙痒可以引发抓挠行为,对机体起到防御保护作用,但受体过度激活会导致过敏、炎症等多种疾病的发生。例如万古霉素引起的红人综合征(red man syndrome,RMS),是一种包括脸部、颈部和上半身的发痒的红斑性皮疹,其发生机制为抗生素和毒素通过与肥大细胞上的MRGPRX2相互作用引起脱颗粒,进而介导该疾病的发生。另外值得关注的是,许多FDA批准的药物如利拉鲁肽、恩夫韦肽、亮丙瑞林等都可以通过激活MRGPRX2在过敏患者中诱发瘙痒症状及过敏性反应,导致这些药物不能有效发挥作用。因此从分子层面解析MRGPRX2如何识别不同的配体并激活下游通路,对于理解痒觉感知产生的机制及靶向该受体的新药研发具有重大意义。
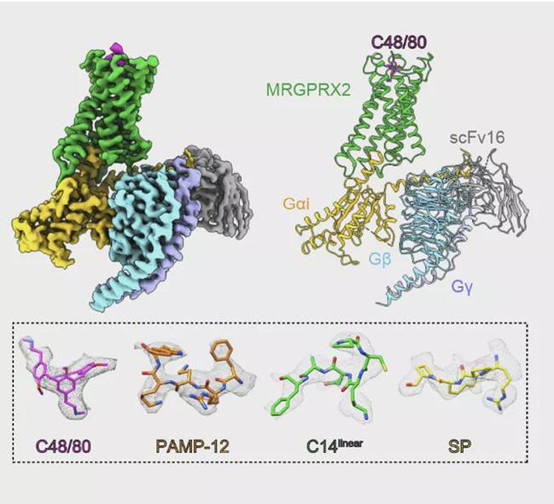
图一 不同配体作用下痒觉受体MRGPRX2与Gi蛋白三聚体复合物的结构
2021年11月17日,医学部孙金鹏和生科院高宁联合团队在Nature上发表了研究论文“Structure, function and pharmacology of human itch receptor complexes”。该研究中,研究团队先是对痒觉受体MRGPRX2对多肽和过敏性药物的感知药理学进行了详细的表征。为进一步揭示其识别机制,团队利用单颗粒冷冻电镜技术解析了不同配体作用下痒觉受体MRGPRX2与Gi蛋白三聚体复合物的结构(图一),发现了痒觉受体非常独特的配体识别口袋;并结合生化和细胞实验揭示了痒觉受体识别不同配体的通用机制,发现了痒觉受体特有的激活方式,该研究系统的揭示了痒觉感知的分子机制,为靶向痒觉受体的药物开发提供理论及结构基础。
具体发现包括:
1、与传统GPCR不同MRGPRX2有着较浅的结合口袋
从MRGPRX2复合物结构中,研究者发现不论化合物配体还是多肽配体与Toggle switch 的距离都要比传统的GPCR(如大麻素受体CB1)远很多(图二),所以这类受体有着不同于传统GPCR的较浅的配体结合口袋,也正是这种较浅的配体与受体的结合模式以及N端及胞外环的可塑性造就了痒觉受体配体的多样性,这也很好的解释了为什么痒觉受体家族在不断演化的过程中,能够识别多种多样的有害刺激从而引发瘙痒。
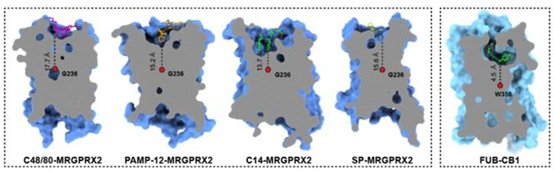
图二 MRGPRX2受体与CB1受体配体结合口袋的比较
2、揭示了MRGPRX2 识别多聚阳离子化合物及短肽的通用机制
许多带有正电荷的碱性小分子,如含有THIQ motif (tetrahydroisoquinoline) 的化合物均可以激活MRGPRX2引起肥大细胞脱颗粒反应进而引发瘙痒,这些碱性化合物由于带有大量正电荷对细胞产生很大损伤,研究人员解析了在带有阳离子的碱性小分子化合物compound 48/80 (C48/80)作用下,MRGPRX2与Gi 三聚体复合物的结构,发现受体上分别由E164/D184 和D254形成的两个酸性口袋可以识别化合物上正电荷的碱性基团(图三)。
另外许多内源短肽以及FDA批准的多种短肽类药物也可以激活MRGPRX2,引起肥大细胞脱颗粒反应,研究人员通过分析多个短肽的结构及生化细胞数据,发现了受体识别短肽类配体的通用基序,即φp9(X0-1) R/Kp10(X2) φp13(X2-3) φp16(X3) R/Kp20(图三),含有该基序的短肽可以激活MRGPRX2引起瘙痒。该研究深入揭示了痒觉受体识别不同配体的通用机制,为临床开发避免瘙痒等副作用的药物提供了理论依据。
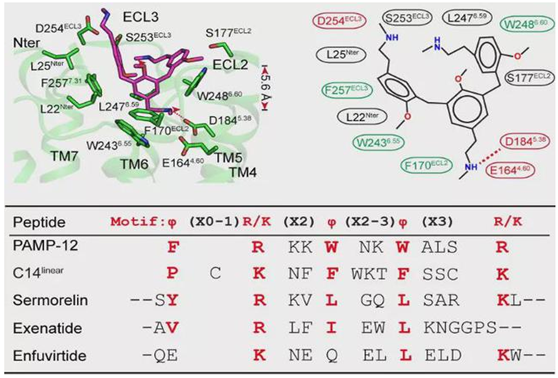
图三 MRGPRX2受体识别配体的通用机制
3、发现了MRGPRX2 独特的激活机制
传统的GPCR通过第六个跨膜螺旋(TM6)中 “toggle switch” 色氨酸 W6.48的构象改变使受体激活,但在MRGPRX2中,该位置的W6.48被甘氨酸G6.48替代 ,更有趣的是,G6.48与TM3上的Y3.36形成氢键,使TM6形成一个显著的上侧弯折,这种特殊的结构方式介导了痒觉受体MRGPRX2的激活,同时TM6中参与激活的关键motif G6.48XXF6.52以及TM3中Y3.36在整个MRGPRX家族都是保守的(图四),因此这是痒觉受体特有的全新激活模式,这些新的发现扩展了人们对GPCR激活机制的认识。
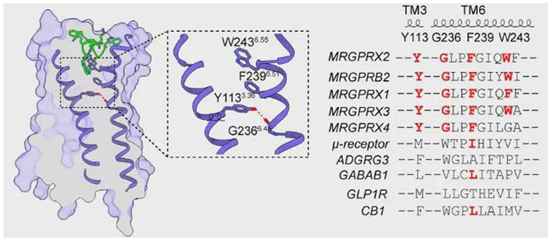
图四 MRGPRX2受体的激活机制
在同期,来自北卡罗来纳大学教堂山分校的Bryan L. Roth/Jonathan F. Fay团队与加州大学旧金山分校的Brian K. Shoichet团队合作发表了背靠背文章“Structure, function and pharmacology of human itch GPCRs”,通过冷冻电镜解析了与痒感知相关的GPCR孤儿受体MRGPRX2和MRGPRX4的三维结构,并通过大量的功能实验研究探索了其相关功能。该文章与本文的工作相互映衬。
总之,该研究分别从原子分辨率和药理学深度阐释了痒觉受体家族感知致痒物并进行信号转导的分子机制,建立了痒觉感知的重要生化理论基础,为止痒药物研发提供了重要的理论和实验依据。
孙金鹏课题组杨帆博士、博士生郭璐璐、王佳、张超、高宁课题组博士生李余(已毕业,现为太阳集团见好就收9728基础医学院博士后)及太阳集团见好就收9728王国鹏博士为本文的共同第一作者;孙金鹏教授和高宁教授为本论文共同通讯作者。本研究得到了太阳集团见好就收9728冷冻电镜平台、电镜实验室、高性能计算平台、生科院仪器中心、国家蛋白质基础设施(北大分平台)的支持。该项目受到国家自然科学基金委和科技部的经费资助。
原文链接:https://www.nature.com/articles/s41586-021-04077-y