检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 澳门太阳集团官网www / 学术科研
BRCA1和BRCA2等重要同源重组(HR)相关基因的突变会导致乳腺癌、卵巢癌、前列腺癌等癌症,这些HR缺陷的癌症细胞通常会对PARP抑制剂(PARPi)表现出很高的敏感性,所以PARPi是治疗此类肿瘤非常有效的药物。但不幸的是,很多复发的癌症患者会表现出对PARPi的耐药性,这其中的一个主要原因之一是因为53BP1或其下游因子也在肿瘤细胞中发生了突变。BRCA1和53BP1拮抗调控了DNA双链断裂(DSBs)修复的两条途径——同源重组和非同源末端连接(NHEJ)。其中DNA末端是否发生剪切过程是DSB修复途径选择的关键因素。在HR中,BRCA1蛋白能促进DSB断裂末端DNA发生剪切,形成3’末端单链悬垂的结构;而在NHEJ通路中起作用的53BP1及其下游RIF1蛋白能抑制这一过程。具体有哪些蛋白在53BP1和RIF1下游起到抑制DNA 末端剪切从而抑制HR,以及这一过程发生的具体机制,目前还并不清楚。
2022年2月17日,太阳集团见好就收9728徐冬一课题组在Nature Communication上发表文章RIF1-ASF1-mediated high-order chromatin structure safeguards genome integrity,发现RIF1蛋白一个下游因子ASF1,和RIF1形成复合体,促进NHEJ途径,抑制由BRCA1介导的HR中DNA末端剪切。同时RIF1-ASF1还能促进DSB附近染色质的异染色质化,通过改变染色质的高级结构保护DNA末端不被剪切,从而促进NHEJ修复途径。
ASF1是一种从酵母到人类细胞都很保守的组蛋白分子伴侣。高等真核生物中含有ASF1a和ASF1b两个旁系同源蛋白。已有研究表明ASF1的功能是将H3-H4提供给组蛋白分子伴侣CAF-1或HIRA,进行核小体的组装。CAF-1和HIRA能通过一个B结构域和ASF1发生相互作用。该研究发现,RIF1上也存在一个类似的B结构域,通过此和ASF1相互作用。 当细胞发生DNA损伤时,ASF1能被53BP1和RIF1招募到损伤的染色质上。ASF1缺失的细胞和RIF1缺失的细胞类似,对DNA损伤诱导药物依托泊苷(Etoposide)和ICRF193都表现出敏感性。通过遗传相互作用分析表明,ASF1作用于RIF1的下游,共同促进NHEJ修复。之前发现,在BRCA1突变的细胞中缺失RIF1,能减弱细胞对于PARPi的敏感性。同样地,ASF1的缺失也能减弱BRCA1突变细胞对于PARPi的敏感性,并恢复细胞内RAD51和RPA32在损伤处的聚集。这说明ASF1和RIF1一起,抑制BRCA1依赖的DNA末端剪切。进一步的机制研究发现,RIF1-ASF1将H3K9me1提供给了DNA断裂位点附近的染色质,而甲基转移酶SUV39h1/h2将之转化为H3K9me3,从而招募异染色质蛋白HP1,促进异染色质化的发生和染色质的压缩。该染色质高级结构的变化,限制了HR中的内切酶如CtIP-MRN等与染色质的接触,从而抑制DNA 末端剪切(图1)。
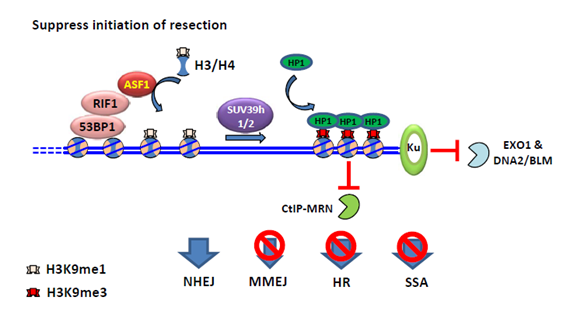
图1:RIF1-ASF1复合体对BRCA1依赖的DSB末端切除抑制的模型。
该研究发现了在NHEJ通路中RIF1下游的重要因子,揭示了NHEJ因子拮抗BRCA1介导的DNA末端剪切的分子机制。同时解释了一些BRCA1突变的肿瘤细胞对PARPi药物出现耐药性的可能原因,为相关癌症治疗提供新的靶标。
太阳集团见好就收97282019届博士冯素敏、2021届博士马赛和2018级博士研究生李可骄为该论文的并列第一作者,太阳集团见好就收9728徐冬一研究员为该论文的通讯作者。此外本研究还得到了太阳集团见好就收9728李晴课题组和以色列耶路撒冷希伯来大学Itamar课题组的帮助。